1. Kata kimia berasal dari bahasa arab “al kimiya” yang artinya ..
a. Pembentuk materi
b. Perubahan materi
c. Penghasil materi
d. Penyusun materi
e. Penanganan materi
Jawaban : B
Pembahasan
Kata alkimia berasal dari Bahasa Arab al-kimiya atau al-khimiya (الكيمياء atau الخيمياء), yang mungkin dibentuk dari partikel al-[3] dan kata Bahasa Yunani[4] khumeia (χυμεία)[5] yang berarti “mencetak bersama”, “menuangkan bersama”, “melebur”, “aloy”, dan lain-lain (dari khumatos, “yang dituangkan, batang logam”).
Etimologi lain mengaitkan kata ini dengan kata “Al Kemi”, yang berarti “Seni Mesir”, karena bangsa Mesir Kuno menyebut negerinya “Kemi” dan dipandang sebagai penyihir sakti di seluruh dunia kuno
2. Kata kimia berasal dari bahasa arab. Yaitu ..
a. Al mia
b. Al kimia
c. Al kimiya
d. Al kimi
e. Al kimiaya
Jawaban : C
Pembahasan
Kata alkimia berasal dari Bahasa Arab al-kimiya atau al-khimiya (الكيمياء atau الخيمياء), yang mungkin dibentuk dari partikel al-[3] dan kata Bahasa Yunani[4] khumeia (χυμεία)[5] yang berarti “mencetak bersama”, “menuangkan bersama”, “melebur”, “aloy”, dan lain-lain (dari khumatos, “yang dituangkan, batang logam”).
3. Kalium mempunyai nomor atom 19 dan nomor massa 39. Jumlah elektron pada ion Kalium adalah . . .
A. 21
B. 20
C. 19
D. 18
E. 17
Pembahasan :
Nomor atom menunjukkan jumlah proton sama dengan jumlah elektron.
Jawaban : C
4. Pada isotop unsur ![]() , jumlah proton dan netron kedua unsur secara berturut – turut adalah . . .
, jumlah proton dan netron kedua unsur secara berturut – turut adalah . . .
A. (26 , 26) : (88 , 88)
B. (26 , 26) : (88 , 138)
C. (26 , 30) : (88 , 138)
D. (26 , 30) : (88 , 266)
E. (26 , 56) : (88 , 138)
Pembahasan :
![]()
- X = lambang unsur
- Z = jumlah proton
- N = nomor atom
- M = massa atom
- Neutron = A – Z
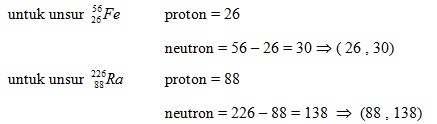
.

7. Nilai bilangan okidasi dari Cr didalam K2CrO4 adalah . . .
a. 4
b. 5
c. 6
d. 7
e. 8
Pembahasan :
8. Nilai bilangan okidasi dari S didalam Na2SO3 adalah . . .
a. 4
b. 5
c. 6
d. 7
e. 8
Pembahasan :
9. Urutan unsur-unsur alkali tanah berdasarkan sifat reduktor dari kuat ke reduktor lemah adalah …
a. Ca, Mg, Sr, Ba
b. Mg, Ca, Ba, Sr
c. Mg, Ca, Sr, Ba
d. Ba, Sr, Ca, Mg
e. Ca, Ba, Mg, Sr
Jawaban : D
Pembahasan :
Sifat reduktor berarti sifat oksidasi. Maka dari bawah keatas ditabel periodik sifat reduktor semakin lemah
10. Pada elektrolisis larutan garam logam alkali atau alkali tanah tidak dihasilkan logamnya karena ….
a. sifat oksidatornya lemah
b. sifat reduktornya lemah
c. garam halidanya mempunyai titik leleh tinggi
d. energi ionisasi tinggi dari logam lain
e. ion logamnya tidak mengalami reduksi
Jawaban : E
Pembahasan
Pada elektrolisis larutan garam logam Alkali atau Alkali tanah tidak menghasilkan logam sebab :
- harga E° lebih kecil dari E° air
- ion logamnya tidak mengalami reduksi
1. Sifat-sifat unsur periode ketiga dari Na sampai Cl berikut adalah yang benar kecuali…
a. Sifat basa makin berkurang
b. Sifat asam makin bertambah
c. Afinitas elektron cenderung berkurang
d. Energi ionisasi cenderung bertambah
e. Keelektronegatifan unsur bertambah
Pembahasan
Sifat unsur periode ketiga dari Na sampai Cl afinitas elektron makin bertambah, sebab jumlah elektron valensi makin banyak, sehingga makin mudah menerima elektron.
Jawaban : C
12. Empat unsur periode ketiga, yaitu : P, Mg, Cl, dan Na. Urutan unsur-unsur tersebut dari yang paling kecil sifat pereduksinya sampai yang paling besar adalah…
a. Na, Cl, Mg, P
b. Cl, P, Mg, Na
c. Cl, P, Na, Mg
d. P, Cl, Na, Mg
e. Na, Mg, P, Cl
Pembahasan :
Urutan unsur periode ketiga dari kiri ke kanan : Na, Mg, Al, Si, P, S, Cl, Ar. Salah satu perubahan sifat unsur periode ketiga dari kiri ke kanan adalah makin mudah tereduksi, berarti sifat oksidator bertambah.
Sebaliknya, sifat reduktor (pereduksi) berkurang. Dengan demikian, untuk sifat pereduksi yang makin besar urutannya adalah : Cl, P, Mg, Na.
13. Setiap unsur mampu membentuk ikatan kimia karena memiliki ….
a. Elekcron valensi
b. Kecendrungan membentuk konfigurasi electron gas mulia
c. Lintasan electron
d. Neutron dalam inti atom
e. Proton dan neutron
Jawaban : B
Pembahasan:
Unsur-unsur gas mulia sukar bereaksi karena unsur-unsur tersebut tergolong unsur yang stabil. Menurut G. N. Lewis dan W. Kossel, kestabilan unsur gas mulia disebabkan oleh electron valensinya yang berjumah delapan, keculi He yang hanya memiliki dua electron.
Setiap atom dalam pembentukan senyawa membentuk konfigurasi electron yang stabil, yaitu :
- Konfigurasi electron gas mulia yang disebut konfigurasi octet atau kaidah oktet,
- Sedangkan Helium disebut kaidah duplet.
Atom-atom suatu unsur berusaha mencapai konfigurasi octet atau duplet dengan cara berikatan dengan atom-atom lain.
Ikatan yang terjadi dapat berupa ikatan ion, kovalen dan kovalen koordinasi.
14. Diantara sifat berikut ini yang bukan sifat senyawa ion adalah …
a. Rapuh
b. Titik leleh tinggi
c. Larutan dapat menghantar listrik
d. Lelehannya dapat menghantar listrik
e. Padatannya dapat menghantar listrik
Jawaban : D
Pembahasan:
Sifat senyawa ion, yaitu:
- Kristalnya keras tetapi rapuh
- Mempunyai titik lebur dan titik didih yang tinggi
- Mudah larut di dalam air
- Dapat menghantar arus listrik dalam keadaaan cair dan larutan, tetapi dalam padatan tidak bisa.
15. Molekul dengan orbital hibrida sp² memiliki bentuk orbital …
A. Linear
B. Segitiga datar
C. Segitiga piramida
D. Tetrahedral
E. Oktahedral
Jawaban : B
Pembahasan :
Segitiga datar atau trigonal planar merupakan bentuk molekul sp²
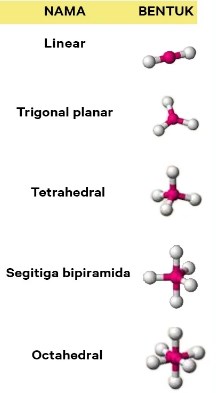
16. Bentuk molekul bipiramida trigonal memiliki orbital hibrida
A. sp
B. sp²
C. sp³
D. sp³d
E. sp³d²
Jawaban : D
Pembahasan :
Yang benar adalah : sp³d
Mengapa demikian?
Contoh : bipiramida trigonal adalah PCl5
Membuktikannya, pertama konfigurasikan dengan asas aufbau unsur pusat yaitu P yg hanya terdiri 1 saja. P nomor atomnya 15
P : 1s², 2s², 2p6, 3s², 3p³
Ambil bagian terakhir mulai dari s
Berarti -> 3s² dan 3p³
17. Berdasarkan susunan kimianya, materi dikelompokkan menjadi tiga berikut ini, kecuali ….
a. unsur
b. senyawa
c. campuran
d. zat
Jawaban : D
Pembahasan
Berdasarkan susunan kimianya materi dikelompokkan menjadi :
- unsur
- senyawa dan
- campuran
Unsur adalah materi atau zat yang tidak dapat dipisah lagi menjadi unsur lain melalui reaksi kimia.
18. Pemisahan minyak bumi menjadi komponen-komponennya dapat dilakukan dengan metode ….
a. filtrasi
b. ekstraksi
c. distilasi bertingkat
d. evaporasi
Jawaban : C
19. Sifat koligatif larutan adalah sifat yang bergantung pada ….
a. Jenis zat terlarut
b. Jenis zat pelaut
c. Jumlah zat pelarut
d. Jumlah zat terlarut
e. Konsentrasi larutan
Jawaban : D
Pembahasan
Sifat koligatif larutan adalah sifat-sifat yang hanya tergantung pada Jumlah (kuantitas) partikel zat terlarut dalam larutan dan tidak bergantung pada jenis atau identitas partikel zat terlarut, tidak peduli dalam bentuk otom, ion, ataupun molekul. Sifat koligatif merupakan sifat yang hanya memandang “kuantitas” bukan “kualitas”.
20. jika suatu larutan mengandung 24 gram MgSO4 dilarutkan dalam 500 gram air.. molalitasnya adalah ….(Mr MgSO4 = 120)
a. 0,5 molal
b. 0,7 molal
c. 0,6 molal
d. 0,4 molal
e. 0,9 molal
Jawaban : D
Pembahasan :
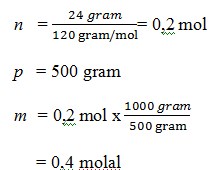


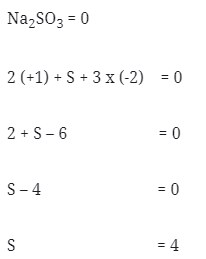


Tidak ada komentar:
Posting Komentar