1. Bahan yang digunakan sebagai elektrode pada sel aki (accu) adalah …
a. Pt dan C
b. Zn dan C
c. Pb dan PbO2
d. Zn dan Cu
e. Cu dan PbO2
Jawaban : C
Pembahasan :
Aki merupakan sel yang banyak kita jumpai karena banyak digunakan pada sepeda motor maupun mobil. Aki temasuk sel sekunder, karena selain menghasilkan arus listrik, aki juga dapat diisi arus listrik kembali.
Secara sederhana Sesuai prinsip pada sel Volta, aki merupakan sel yang terdiri dari elektrode Pb sebagai anode dan PbO2 sebagai katode dengan elektrolit H2SO4.
2. Diketahui :
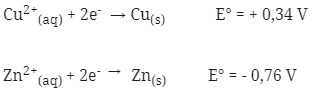
Bila kedua logam tersebut dipasangkan untuk membentuk sel volta, maka pernyataan berikut yang tidak benar adalah …
a. Elektrode Zn teroksidasi dan Elektrode Cu tereduksi
b. Elektrode Zn Sebagai Anode dan Cu sebagai Katode
c. Potensial sel yang dihasilkan adalah 1,10 volt
d. Notasi selnya : Zn(s)|Zn2+(aq)||Cu2+(aq)|Cu E°sel = 1,10 V
e. Dalam sistem sel volta tersebut elektron bergerak dari Cu menuju Zn
Jawaban : E
Pembahasan :
- Logam yang memiliki E° lebih kecil selalu merupakan Anode (mengalami oksidasi), berarti yang termasuk anode adalah Zn (E° = – 0,76 V) karena memiliki E° yang lebih kecil dari pada Cu (E° = + 0,34 V).
- Karena Zn sebagai Anode maka mengalami oksidasi sedangkan Cu sebagai Katode mengalami reduksi
- Notasi sel volta : Anode|ion||ion|katode
Maka :
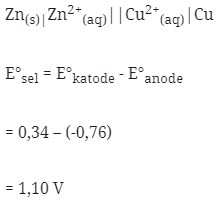
- Dalam sel volta elektron bergerak dari Anode ke Katode berarti dari Zn Menuju Cu
Kesimpulannya, pernyataan yang tidak benar adalah jawaban E
3. Logam yang tidak diperoleh dengan proses elektrolisis adalah …
a. Natrium
b. Aluminium
c. Magnesium
d. Kalsium
e. Merkuri
Jawaban : E
Pembahasan :
Logam-logam Natrium, Aluminium, Magnesium, dan Kalsium diperoleh dengan proses elektrolisis, sebab logam-logam ini tergolong reduktor kuat. Logam Merkuri (Raksa) adalah logam yang berwujud cair pada suhu kamar, tidak diendapkan di Katode.
Logam ini diperoleh dengan Pemanggangan HgS atau pemanasan HgO.
Reaksinya :
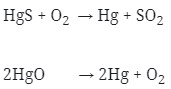
4. Pada elektrolisis larutan CuSO4 dengan elektrode Pt, dialirkan arus listrik 2 Ampere selama 965 detik (Ar Cu=63,5) maka banyaknya logam tembaga yang dihasilkan … mg
a. 317,5
b. 635,0
c. 952,5
d. 1.270
e. 1.905
Jawaban : B
Pembahasan :
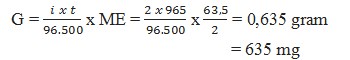


Tidak ada komentar:
Posting Komentar