1.Tujuan
-Untuk mengetahu dan memahami kalorimetri
-Untuk mengetahui dan memahami entalpi pembentukan dan entalppi pembentukan standar
-Untuk mengetahui reaksi pengenceran
2.Alat dan bahan
a. Tabung Reaksi
b. Labu Erlenmeyer
c. Gelas Beaker
d. Multimeter
Bahan Yang Digunakan
a. Logam Cu
b. Logam Mg
c. Logam Zn
3. Dasar Teori
Chapter 6.5 Kalorimetri
kalor pada proses perubahan fisika
dan perubahan kimia diukur dengan kalorimeter
perlu diperhatikan terlebih dahulu yakni :
Kalor Jenis dan Kapasitas Kalor
Kalor jenis atau
kalor spesifik (c) suatu zat adalah jumlah kalor yang dibutuhkan untuk
menaikkan suhu satu gram zat sebesar satu derajat Celcius. Kalor jenis memiliki
satuan J/g°C. Kapasitas kalor (C) suatu zat adalah jumlah kalor yang
dibutuhkan untuk menaikkan suhu kuantitas tertentu zat sebesar satu derajat
Celcius. Satuannya adalah J/°C. Kalor jenis adalah sifat intensif sedangkan
kapasitas kalor adalah sifat ekstensif (ingat sifat fisika dan sifat kimia
zat). Hubungan antara kapasitas kalor dan kalor jenis suatu zat
C = m . c
di mana m adalah massa zat dalam gram. Misalnya, kalor jenis air adalah 4,184 J/g°C, dan kapasitas kalor dari 60,0 g air adalah
(60,0g)(4,184 J/g°C) = 251 J/°C
Jika kalor jenis dan jumlah zat diketahui, maka perubahan suhu (Δt)
dalam sampel akan memberikan informasi jumlah kalor (q) yang telah
diserap atau dilepaskan dalam proses tertentu. Persamaan untuk menghitung
perubahan kalor diberikan oleh
q = m.c.Δt
q = C.Δt
dimana Δt adalah perubahan suhu:
Δt = takhir - tawal
Tanda konvensi untuk q adalah sama dengan tanda untuk perubahan entalpi; q positif untuk proses endotermis dan negatif untuk proses eksotermis.
Kalorimetri Volume Tetap
Kalor pembakaran biasanya diukur dengan menempatkan sejumlah senyawa yang diketahui massanya dalam wadah baja yang disebut "kalorimeter bom volume tetap", yang diisi dengan oksigen pada tekanan sekitar 30 atm. Bom tertutup direndam dalam air dengan kuantitas yang diketahui, seperti yang ditunjukkan pada Gambar 6.8. Sampel dinyalakan dengan listrik, dan kalor yang dihasilkan oleh reaksi pembakaran dapat dihitung secara akurat dengan mencatat kenaikan suhu air. Kalor yang dilepaskan oleh sampel diserap oleh air dan bom. Desain khusus dari kalorimeter memungkinkan untuk berasumsi bahwa tidak ada kalor (atau massa) yang hilang ke lingkungan selama waktu yang dibutuhkan untuk melakukan pengukuran. Oleh karena itu, dapat disebut bom dan air yang terendam sebagai sebuah sistem yang terisolasi. Karena tidak ada kalor masuk ataupun meninggalkan sistem selama proses berlangsung, perubahan kalor dari sistem (qsis) harus nol dan dapat ditulis
qsis = qkal + qrx (6.14)
= 0
dimana qkal adalah perubahan kalor untuk kalorimetri dan qrx adalah perubahan kalor untuk reaksi. Sehingga,
qrx = -qkal (6.15)
Untuk menghitung qkal, perlu diketahui kapasitas kalor dari kalorimeter (Ckal) dan kenaikan suhu, yaitu,
qkal = CkalΔt (6.16)
Kuantitas Ckal dikalibrasi dengan membakar zat yang telah diketahui dengan akurat kalor pembakarannya. Sebagai contoh, diketahui bahwa pembakaran 1 g asam benzoat (C6H5COOH) melepas kalor 26,42 kJ. Jika kenaikan suhu menjadi 4,673°C, maka kapasitas kalor kalorimeter diberikan oleh persamaan:
Setelah Ckal telah ditentukan, kalorimeter dapat digunakan untuk
mengukur kalor pembakaran zat lainnya.
Gambar 6.8. Sebuah
kalorimeter bom volume tetap. Kalorimeter diisi dengan gas oksigen sebelum
ditempatkan di ember. Sampel dinyalakan dengan listrik, dan kalor yang
dihasilkan oleh reaksi dapat secara akurat ditentukan dengan mengukur kenaikan
suhu dalam jumlah yang diketahui disekitar air.
Perhatikan bahwa karena reaksi dalam kalorimeter bom terjadi pada volume tetap daripada keadaan tekanan tetap, Perubahan kalor tidak sesuai dengan perubahan entalpi ΔH (lihat Bagian 6.4). Hal ini dimungkinkan untuk memperbaiki perubahan kalor yang diukur sehingga hasilnya sesuai dengan nilai-nilai ΔH, tetapi koreksi biasanya cukup kecil sehingga tidak akan disibukkan dengan perhitungan ini. Akhirnya, hal itu adalah menarik untuk dicatat bahwa kandungan energi dari makanan dan bahan bakar (biasanya dinyatakan dalam kalori dimana 1 kal = 4,184 J) diukur dengan kalorimeter volume tetap.
Kalorimetri Tekanan
Sebuah perangkat yang lebih sederhana daripada kalorimeter volume tetap adalah kalorimeter tekanan tetap, yang digunakan untuk menentukan perubahan kalor untuk reaksi bukan pembakaran. Sebuah crude kalorimeter tekanan tetap dapat dibuat dari dua buah cangkir yang terbuat dari styrofoam, seperti yang ditunjukkan pada Gambar 6.9. Perangkat ini mengukur efek kalor dari berbagai reaksi, seperti netralisasi asam-basa, serta kalor dari larutan dan kalor dari pengenceran. Karena tekanan tetap, perubahan kalor untuk proses (qrx) adalah sama dengan perubahan entalpi (ΔH). Seperti dalam kasus kalorimeter volume tetap, diperlakukan kalorimeter sebagai suatu sistem yang terisolasi. Selanjutnya, dapat diabaikan kapasitas kalor kecil dari secangkir kopi dalam perhitungan. Tabel 6.3 daftar beberapa reaksi yang telah dipelajari dengan kalorimeter tekanan tetap.
Gambar 6.8. Sebuah kalorimeter bom volume tetap. Kalorimeter diisi dengan gas oksigen sebelum ditempatkan di ember. Sampel dinyalakan dengan listrik, dan kalor yang dihasilkan oleh reaksi dapat secara akurat ditentukan dengan mengukur kenaikan suhu dalam jumlah yang diketahui disekitar air.
Perhatikan bahwa karena reaksi dalam kalorimeter bom terjadi pada volume tetap daripada keadaan tekanan tetap, Perubahan kalor tidak sesuai dengan perubahan entalpi ΔH (lihat Bagian 6.4). Hal ini dimungkinkan untuk memperbaiki perubahan kalor yang diukur sehingga hasilnya sesuai dengan nilai-nilai ΔH, tetapi koreksi biasanya cukup kecil sehingga tidak akan disibukkan dengan perhitungan ini. Akhirnya, hal itu adalah menarik untuk dicatat bahwa kandungan energi dari makanan dan bahan bakar (biasanya dinyatakan dalam kalori dimana 1 kal = 4,184 J) diukur dengan kalorimeter volume tetap.
Chapter 6.6. Entalpi Reaksi dan Entalpi Pembentukan Standar
Istilah "permukaan laut" titik referensi untuk semua ungkapan entalpi disebut entalpi pembentukan standar (ΔHºf). Zat dikatakan dalam keadaan standar pada 1 atm, maka istilah "entalpi standar" diberi superskrip (indeks atas) "º" merupakan keadaan standar (1 atm), dan subskrip "f" singkatan formasi (pembentukan). Dengan konvensi, entalpi pembentukan standar dari setiap unsur dalam bentuk yang paling stabil adalah nol. Mengambil unsur oksigen sebagai contoh, molekul oksigen (O₂) lebih stabil daripada bentuk allotropik lain dari oksigen, ozon (O₃), pada 1 atm dan 25°C. Dengan demikian, kita dapat menulis ΔHºf (O₂) = 0, tetapi ΔHºf (O₃) = 142,2 kJ/mol. Demikian pula, grafit adalah bentuk allotropik lebih stabil karbon daripada intan pada 1 atm dan 25ºC, jadi kita mengetahui ΔHºf (C, grafit) = 0 dan ΔHºf(C, intan) = 1,90 kJ/mol. Berdasarkan referensi ini untuk unsur, sekarang dapat didefinisikan entalpi pembentukan standar senyawa sebagai perubahan kalor yang terjadi ketika 1 mol senyawa yang terbentuk dari unsur-unsur pada tekanan 1 atm. Tabel 6.4 menunjukkan daftar entalpi pembentukan standar untuk sejumlah unsur dan senyawa. (Untuk daftar yang lebih lengkap nilai ΔHºf dapat lihat pada Data Termodinamika. Perhatikan bahwa meskipun keadaan standar tidak menentukan suhu, kita selalu akan menggunakan nilai ΔHºf yang diukur pada 25ºC untuk diskusi karena sebagian data termodinamika yang dikumpulkan pada suhu ini.
Pentingnya entalpi pembentukan standar adalah bahwa sekali diketahui nilai-nilainya, maka dapat dengan mudah menghitung entalpi reaksi standar (ΔHºrx) yang didefinisikan sebagai entalpi reaksi yang dilakukan pada 1 atm. Sebagai contoh, perhatikan reaksi hipotetis
aA + bB → cC + dD
dimana a, b, c, dan d adalah koefisien stoikiometri. Untuk reaksi ini ΔHºrx diberikan oleh
Dapat digeneralisasi Persamaan (6.17) sebagai
ΔHºrx = ΣnΔHºf (produk) - ΣmΔHºf (reaktan) (6.18)
dimana m dan n menyatakan koefisien stoikiometri untuk reaktan dan produk, dan Σ (sigma) berarti "jumlah." Perhatikan bahwa dalam perhitungan, koefisien stoikiometri hanya bilangan tanpa satuan.
Untuk menggunakan Persamaan (6.18) dalam menghitung ΔHºrx, arus diketahui nilai ΔHºf dari senyawa yang terlibat dalam reaksi. Nilai-nilai ini dapat ditentukan dengan menggunakan metode langsung atau metode tidak langsung.
Metode Langsung
Metode ini untuk mengukur ΔHºf yang bekerja untuk senyawa yang dapat dengan mudah disintesis dari unsur-unsurnya. Misalkan ingin mengetahui entalpi pembentukan karbon dioksida. Maka harus diukur entalpi reaksi ketika karbon (grafit) dan molekul oksigen pada keadaan standar diubah menjadi karbon dioksida dalam keadaan standar:
C(grafit) + O₂(g) → CO₂ ΔHºrx = -393,5kJ/mol
Diketahui dari pengalaman bahwa pembakaran ini mudah berjalan sampai selesai. Jadi, dari Persamaan (6.18) dapat ditulis
ΔHºrx = ΔHºf(CO₂,g) - [ΔHºf(graftt) + ΔHºf(O₂,g)]
Karena grafit dan O₂ adalah bentuk alotropik stabil dari unsur-unsur, berikut bahwa ΔHºf (C, grafit) dan ΔHºf(O₂, g) adalah nol. Karena itu,
ΔHºrx = ΔHºf (CO₂,g) = -393,5kJ/mol
atau
ΔHºf(CO₂,g) = -393,5kJ/mol
Perhatikan bahwa seyogyanya menetapkan nol untuk ΔHºf setiap unsur dalam bentuk yang paling stabil pada keadaan standar tidak mempengaruhi perhitungan dengan cara apapun. Ingat, dalam kimia hanya memperhatikan kalor pada perubahan entalpi karena perubahannya dapat ditentukan secara eksperimen sedangkan nilai entalpi mutlak tidak bisa. Pilihan nol "titik referensi" untuk entalpi membuat perhitungan lebih mudah untuk ditangani. Sekali lagi mengacu pada ketinggian analogi terestrial, ditemukan bahwa Gunung Everest adalah 8.708 kaki lebih tinggi dari Gunung McKinley. Perbedaan ketinggian ini tidak terpengaruh oleh keputusan untuk mengatur "permukaan laut" pada 0 kaki atau pada 1000 kaki.
Senyawa lain yang dapat dipelajari dengan metode langsung adalah SF₆, P₄O₁₀, dan CS₂. Persamaan yang mewakili sintesisnya
S(rombik) + 3F₂(g) → SF₆(g)
P₄(putih) + 5O₂(g) → P₄O₁₀(s)
C(grafit) + 2S(rombik) → CS₂(l)
Perhatikan bahwa S(rombik) dan P(putih) adalah alotrop paling stabil sulfur dan fosfor, masing-masing, pada 1 atm dan 25°C, sehingga nilai ΔHºf nya adalah nol.
Metode Tidak Langsung
Banyak senyawa tidak dapat langsung disintesis dari unsur-unsurnya. Dalam beberapa kasus, reaksi berlangsung terlalu lambat, atau reaksi samping yang menghasilkan zat selain senyawa yang diinginkan. Dalam kasus ini, ΔH dapat ditentukan dengan pendekatan tidak langsung, yang didasarkan pada hukum Hess dari penjumlahan kalor, atau disebut hukum Hess, dinamakan menurut nama kimiawan Swiss Germain Hess. Hukum Hess dapat dinyatakan sebagai berikut: Ketika reaktan diubah menjadi produk, perubahan entalpi adalah sama entahkah reaksi berlangsung dalam satu langkah atau dalam serangkaian langkah-langkah. Dengan kata lain, jika bisa memecah reaksi yang diinginkan menjadi serangkaian reaksi yang ΔHºrx nya dapat diukur, maka dapat dihitung ΔHºrx untuk reaksi keseluruhan. Hukum Hess didasarkan pada kenyataan bahwa karena H adalah fungsi keadaan, ΔH hanya bergantung pada keadaan awal dan keadaan akhir (yaitu, hanya pada sifat reaktan dan produk). Perubahan entalpi akan sama entahkah keseluruhan reaksi berlangsung dalam satu langkah atau banyak langkah.
Sebuah analogi hukum Hess adalah sebagai berikut. Misalkan seseoarang pergi dari lantai pertama ke lantai enam sebuah gedung dengan lift. Nilai energi potensial gravitasi (yang sesuai dengan perubahan entalpi keseluruhan proses) adalah sama entahkah ia pergi langsung ke sana atau berhenti di setiap lantai di jalan menuju lantai enam (memecah perjalanan menjadi serangkaian langkah-langkah).
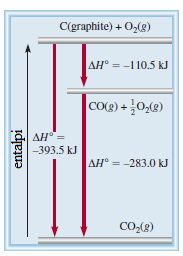
Misalkan entalpi pembentukan standar karbon monoksida (CO), mungkin dapat dituliskan persamaan reaksi sebagai
C(grafit) + ½O₂(g) → CO(g)
Namun, pembakaran grafit juga menghasilkan beberapa karbon dioksida (CO₂), sehingga tidak bisa diukur perubahan entalpi untuk CO secara langsung seperti yang ditunjukkan. Sebaliknya, jika harus menggunakan cara tidak langsung, berdasarkan hukum Hess. Hal ini dimungkinkan untuk melaksanakan dua reaksi yang terpisah berikut, dengan melakukan proses sampai selesai:
(a) C(grafit) + O₂(g) → CO₂(g) ΔHºrx = -393,5kJ/mol
(b) CO(g) + ½O₂(g) → CO₂(g) ΔHºrx = -283,0kJ/mol
Pertama, jika Persamaan (b) dibalik untuk mendapatkan
(c) CO₂(g) → CO(g) + ½O₂(g) ΔHºrx = +283,0kJ/mol
Karena persamaan kimia dapat ditambahkan dan dikurangi seperti persamaan aljabar, maka dilakukan operasi (a) + (c) dan diperoleh
(a) C(grafit) + O₂(g) → CO₂(g) ΔHºrx = -393,5kJ/mol
(c) CO₂(g) → CO(g) + ½O₂(g) ΔHºrx = +283,0kJ/mol
_________________________________________________+
(d) C(grafit) + ½O₂(g) → CO(g) ΔHºrx = -110,5kJ/mol
Dengan demikian, ΔHof(CO) = -110,5 kJ/mol. Menengok ke belakang, kita melihat bahwa keseluruhan reaksi adalah pembentukan CO2 [Persamaan (a)], yang dapat dibagi menjadi dua bagian [Persamaan (d) dan (b)]. Gambar 6.10 menunjukkan skema keseluruhan prosedur.
Gambar 6.10. Perubahan entalpi untuk pembentukan 1 mol CO₂ dari grafit dan O₂ dapat dipecah menjadi dua langkah menurut hukum Hess.
Aturan umum dalam menerapkan hukum Hess adalah untuk mengatur serangkaian persamaan kimia (sesuai dengan serangkaian langkah) sedemikian rupa, ketika ditambahkan bersama-sama, semua spesi akan membatalkan kecuali untuk reaktan dan produk yang muncul dalam reaksi keseluruhan. Ini berarti bahwa kita ingin unsur di sebelah kiri dan senyawa yang diinginkan di sebelah kanan panah. Selanjutnya, kita sering perlu untuk memperbanyak sebagian atau seluruh persamaan yang mewakili langkah-langkah individu dengan koefisien yang sesuai.
Chapter 6.7 KALOR LARUTAN DAN PENGENCERAN
Meskipun sejauh ini telah berfokus pada pengaruh energi panas yang dihasilkan dari reaksi kimia, sebagian proses fisika, seperti mencairnya es atau kondensasi uap, juga melibatkan penyerapan atau pelepasan kalor. Perubahan entalpi juga terjadi ketika suatu zat terlarut larut dalam pelarut atau ketika larutan diencerkan. Sekarang perhatikan dua proses fisika terkait dengan ini, yang melibatkan kalor larutan dan pengenceran.
Dalam sebagian besar kasus, melarutkan zat terlarut dalam pelarut menghasilkan perubahan kalor yang dapat diukur. Pada tekanan tetap, perubahan kalor adalah sama dengan perubahan entalpi. Kalor larutan, atau entalpi larutan (ΔHlar) adalah kalor yang dihasilkan atau diserap ketika sejumlah zat terlarut larut dalam sejumlah pelarut. Kuantitas ΔHlar merupakan selisih antara entalpi larutan akhir dan entalpi komponen awal (yaitu, zat terlarut dan pelarut) sebelum dicampur. Sehingga
ΔHlar = Hlar - Hkomp
Baik Hlar atau Hkomp (komponen) tidak dapat diukur, tetapi perbedaannya (ΔHlar) dapat segera ditentukan dalam kalorimeter tekanan tetap. Seperti perubahan entalpi lainnya, ΔHlar positif untuk proses endotermis (menyerap kalor) dan negatif untuk proses eksotermis (melepas kalor).

Gambar 6.11 Proses larutan NaCl. Proses ini dapat dianggap terjadi dalam dua langkah yang terpisah: (1) pemisahan ion dari keadaan kristal menjadi gas dan (2) hidrasi ion gas. Kalor pelarutan adalah sama dengan perubahan energi untuk kedua langkah ini, ΔHlar = U + ΔHhidr.
Perhatikan kalor larutan dari sebuah proses di mana sebuah senyawa ionik adalah zat terlarut dan air adalah pelarut. Misalnya, apa yang terjadi ketika padatan NaCl larut dalam air? Dalam NaCl padat, ion-ion Na⁺ dan Cl⁻ berikatan bersama oleh gaya (elektrostatik) positif-negatif, tetapi ketika kristal kecil NaCl larut dalam air, jaringan tiga dimensi dari ion terurai menjadi satuan individu. (Struktur NaCl padat ditunjukkan pada Gambar 6.11). Pemisahan ion Na⁺ dan Cl⁻ distabilkan dalam larutan oleh interaksi ion-ion dengan molekul air (lihat Gambar 6.12). Ion ini dikatakan terhidrasi. Dalam air hal ini memainkan peran mirip dengan isolator listrik yang baik. molekul air melindungi ion (Na⁺ dan Cl⁻) dari satu sama lain dan secara efektif mengurangi daya tarik elektrostatik yang menahan keduanya saat dalam keadaan padat. Kalor dari larutan didefinisikan oleh proses berikut:
NaCl(s) + H₂O(l) → Na⁺(aq) + Cl⁻(aq) ΔHlar=?

Gambar 6.12. Hidrasi ion Na+ dan Cl-
Melarutkan senyawa ionik seperti NaCl dalam air melibatkan interaksi kompleks antara zat terlarut dan spesi pelarut. Namun, untuk tujuan analisis kita dapat membayangkan bahwa proses larutan berlangsung dalam dua langkah terpisah, diilustrasikan pada Gambar 6.11. Pertama, ion Na⁺ dan Cl⁻ dalam kristal padat dipisahkan dari satu sama lain dan diubah menjadi gas:
energi + NaCl(s) → Na⁺(g) + Cl⁻(g)
Energi yang dibutuhkan untuk sepenuhnya memisahkan satu mol senyawa ionik padat menjadi ion-ion gas disebut energi kisi (U). Energi kisi NaCl adalah 788 kJ/mol. Dengan kata lain, kita perlu untuk memasok 788 kJ energi untuk memecah 1 mol NaCl padat menjadi 1 mol ion Na⁺ dan 1 mol ion Cl⁻ gas.
Selanjutnya, ion "gas" Na⁺ dan Cl⁻ masuk ke air dan menjadi terhidrasi:
Na⁺(g) + Cl⁻(g) + H₂O(l) → Na⁺(aq) + Cl⁻(aq) + energi
Perubahan entalpi yang berhubungan dengan proses hidrasi disebut kalor hidrasi, ΔHhidr (kalor hidrasi adalah kuantitas negatif untuk kation dan anion). Menerapkan hukum Hess, adalah mungkin untuk mempertimbangkan ΔHlar sebagai jumlah dari dua kuantitas terkait, energi kisi (U) dan kalor hidrasi (ΔHhidr), seperti yang ditunjukkan pada Gambar 6.11:
ΔHlar = U + ΔHhidr
sehingga
NaCl(s) → Na+(g) + Cl-(g) U = 788kJ/mol
Na+(g) + Cl-(g) + H2O(l) → Na+(aq) + Cl-(aq) ΔHhidr = -784kJ/mol
____________________________________________________________+
NaCl(s) + H2O(l) → Na+(aq) + Cl-(aq) ΔHlar = 4kJ/mol

Kalor Pengenceran
Ketika larutan yang disiapkan sebelumnya diencerkan, yaitu, jika pelarut berlebih ditambahkan untuk menurunkan konsentrasi keseluruhan zat terlarut, kalor biasanya dilepas atau diserap. Kalor pengenceran adalah perubahan kalor yang terkait dengan proses pengenceran. Jika proses pelarutan tertentu adalah endoterm dan larutan selanjutnya diencerkan, kalor akan diserap oleh larutan yang sama dari lingkungan. Kebalikannya berlaku untuk larutan eksoterm kalor akan dibebaskan jika pelarut berlebih ditambahkan untuk mengencerkan larutan. Oleh karena itu, selalu berhati-hati ketika bekerja pada prosedur pengenceran di laboratorium. Karena kalor pengenceran yang sangat eksoterm, misalnya asam sulfat (H₂SO₄) pekat menimbulkan masalah sangat berbahaya jika konsentrasinya harus dikurangi dengan mencampurnya dengan air tambahan. H₂SO₄ pekat terdiri dari 98 persen asam dan 2 persen air berdasarkan massa. Mencampurnya dengan air melepaskan sejumlah besar kalor ke lingkungan. Proses ini sangat eksotermis bahwa kita tidak harus mencoba untuk mengencerkan asam pekat dengan menambahkan air untuk itu. Kalor yang dihasilkan bisa menyebabkan larutan asam mendidih dan memercikan larutan. Prosedur yang direkomendasikan adalah dengan menambahkan asam pekat perlahan (bisa melalui dinding tabung/gelas tetes demi tetes) ke air (sambil terus diaduk).
4.percobaan
-Siapkan alat dan bahan
-letakkan alat dan bahannya di proteus
-sambungkan semua komponen
-simulasikan rangkaian yang sudah dibuat
Rangkaian suhu LM35 setelah dijalankan :
Gambar rangkaian simulasi saat temperatur antara 16 - 30 derajat Celcius (Motor dalam keadaan OFF)
Gambar rangkaian simulasi ketika mencapai suhu < 16
5. Video
6. Link Download
File Vidio [download]



















Tidak ada komentar:
Posting Komentar